No artigo Medição de pH pudemos aprender sobre o quê se trata a medição de pH e quais suas principais aplicações nos mais diversos segmentos industriais, além de vermos alguns tipos de indicadores e medidores.
Contudo, um ponto muito difundido é quanto a sua faixa de medição, que é a tão popular faixa entre 0 e 14.
Mas é possível que exista um valor de pH fora desses limites, isto é, menor que zero ou maior que 14?
A resposta é sim!
É possível que haja pH fora desses limites, contudo não é comum de ocorrer, ou depende de condições específicas.
O pH é calculado como o logaritmo negativo de base dez da concentração molar do íon H+ ([H+] – onde [] representa concentração).
pH = – log [H+]
É importante notar que para cada variação de 10 vezes na concentração, o pH varia uma unidade.
Por exemplo, uma solução com pH = 4,00 tem 10 vezes mais íons H+ em solução do que outra com pH = 5,00.
Isso pode ser crítico em alguns processos de medição onde é importante manter sua concentração dentro de faixas estreitas.
Assim, vemos a necessidade de se medir o pH com pelo menos uma casa decimal.
Por sua abundância e acessibilidade, a água é o solvente mais usado no preparado das mais diversas soluções; consequentemente, é usada como padrão na escala de pH que usamos corriqueiramente.
O H+ normalmente existe associado e não isolado, e o termo correto para se referir a ele é íon hidrônio (H3O+):
H+ + H2O → H3O+
Logo, podemos escrever a dissociação da água como:
H2O → H3O+ + OH–
Devido ao baixo grau de dissociação da água, essa relação acima é considerada constante, sendo chamada de produto iônico da água (Kw = 10-14 mol/L).

Mas e o pH fora da faixa 0-14?
Há algum tempo foi descoberto que o pH é determinado decisivamente pela atividade dos íons de H+ e não pela sua concentração.
A atividade iônica é uma relação entre a concentração (mol/L e mol/kg) e o coeficiente de atividade e reflete as interações que íons de hidrogênio estabelece com o meio.
Em soluções diluídas, que é a maioria das soluções que lidamos no dia a dia, a concentração é aproximadamente igual à atividade iônica, então pudemos usá-las indiferentemente sem adicionar fontes de erros consideráveis.
O método comum de determinação de pH começa a partir de 1,0 mol/L e valores menores, uma vez que trata de soluções diluídas.
Isso ocorre porque 1,0 mol/L é o limite superior onde atividade iônica e concentração podem ser consideradas iguais, e este é o motivo que a faixa de medição de pH se encontra entre 0-14.
Para concentrações diluídas, os íons se comportam como envolvidos apenas por moléculas do solvente e as interações intermoleculares são as mesmas a maior parte do tempo.
Já para concentrações maiores que 1,0 mol/L, começa a existir interações entre as moléculas de soluto, fazendo com que a atividade iônica não seja a mesma.
Esse é um dos motivos de não falarmos sobre pH quando tratamos de soluções muito concentradas, geralmente nos referimos a outros termos, como o título de uma solução, que representa a quantidade em massa de soluto na massa da solução.
Como já dito, não é impossível conseguir valores de pH fora da faixa convencional.
Para termos uma noção, para conseguirmos um litro de solução aquosa com pH = –1,0, precisaríamos dissolver quase um 1,0 kg de ácido fosfórico, por exemplo, com menos de meio litro de água.
Para um pH = 15,0 teríamos uma abordagem parecida, precisaríamos de algumas centenas de gramas de NaOH ou KOH, por exemplo, para conseguir fazer 1,0 litro de solução.
Essa quantidade tão grande de soluto ácido/básico muitas vezes não é solúvel o suficiente para atingir valores que estejam tão fora da faixa padrão de pH.
Outra forma na qual o pH pode ser diferente
Outra maneira na qual o pH pode existir fora dos limites convencionais é quando mudamos o solvente.
A escala padrão é baseada no comportamento dos íons em meio aquoso, porém em alguns casos a quantidade de água pode ser reduzida ou mesmo substituída por outro solvente.
Isso muda completamente a faixa de medição – como mostrado na figura abaixo.
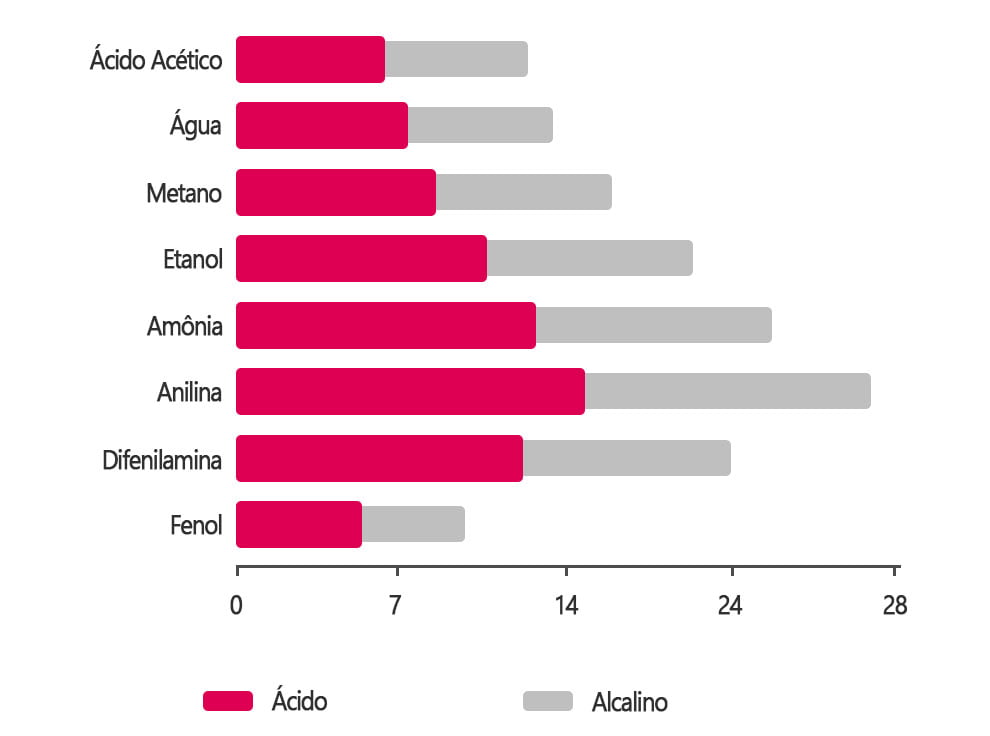
Essa mudança do solvente pode agregar outros procedimentos quando comparados com aqueles usados em medição com solução aquosa.
Esta mudança pode englobar o tempo de condicionamento do eletrodo (elemento sensor), além do fato que ele deve estar devidamente calibrado para o procedimento pretendido.
Concluindo, é possível sim termos medições de pH negativas ou maiores que 14 em soluções aquosas.
Porém vemos que a solução aquosa é apenas um meio para determinação do pH, outros solventes podem ser utilizados e essa faixa variará, o que não significa que é uma medição errada, mas apenas uma nova perspectiva de medição que temos.
Fontes
pH of Non-Aqueous Solutions and Bronsted-Lowry Acid-Base Theory
A guide to pH Measurement – the theory and practice of laboratory pH applications
Himmel, Daniel; Goll, K Sascha; Leito, Ivo; Krossing, Ingo. A Unified pH Scale for All Phases. 16/08/2010


